Recenti scoperte potrebbero rivoluzionare ciò che si sapeva circa le modalità di smaltimento dei rifiuti del cervello: l’esistenza di un sistema linfatico a livello cerebrale, infatti, aprirebbe nuove affascinanti prospettive.
Il sistema linfatico
La circolazione linfatica svolge un ruolo cuciale nella rimozione di fluidi in eccesso e di macromolecole di rifiuto presenti nell’interstizio, ovvero nello spazio tra una cellula e l’altra (Secker e Harvey, 2015). Si tratta di un sistema presente in quasi tutti i distretti del corpo umano che serve a garantire una buona omeostasi tissutale attraverso un’operazione di drenaggio: porta lipidi, proteine e fluidi dallo spazio intercellulare al sistema sanguigno. Altro compito fondamentale è quello che ricopre a livello immunitario: favorisce la circolazione delle cellule immunitarie e degli antigeni necessari ad innescare le risposte immunitarie stesse.
E’ composto da un tipo di vasi specifici, che si discontano per costituzione da quelli vascolari, e che dal punto di vista biochimico si contraddistingue per la presenza di specifici marker – estremamente utili per consentire un loro riconoscimento: PROX1, VEGRF3 , CCL21; LYVE1, PDPN e integrina alfa 9.
I vasi linfatici possono essere distinti in due tipi: vasi periferici e vasi di conduzione. I vasi periferici, che nascono a fondo cieco nei tessuti, sono dotati di valvole a nido di rondine, la cui funzione è quella di garantire il flusso nella corretta direzione. I vasi periferici a loro volta confluiscono tra loro e diventano di calibro sempre maggiore, andando a terminare in due grossi vasi di conduzione: il dotto toracico e il dotto linfatico destro. I vasi periferici e di conduzione si distinguono nell’espressione di molecole di adesione e quindi per la possibilità di cellule e fluidi di accedervi.
Il sistema linfatico non è distribuito ovunque: sistema nervoso centrale, ossa, midollo osseo, parte materna della placenta ed endomisio dei muscoli mancano di vasi linfatici, anche se sono provvisti di condotti prelinfatici in grado di drenare il liquido interstiziale ai linfonodi zonali. Cristallino, cornea, epidermide, cartilagine e tonaca intima delle arterie di grosso calibro mancano della vascolarizzazione linfatica, ma anche di quella sanguigna.
Ma recenti scoperte aprono la porta a nuovi scenari.
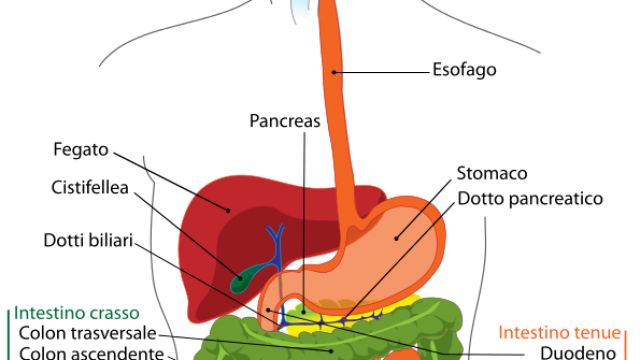
Qualche utile dettaglio sul cervello
Il cervello è avvolto da un sistema di membrane chiamate meningi. Si distinguono tre strati:
- la pia madre, strettamente attaccata alla superficie del cervello,
- l’aracnoide, membrana priva di vasi sanguigni che ricopre lo spazio subaracnoideo
- la dura madre, che non solo è vascolarizzata ma è anche fusa alle ossa craniche.
Da sempre il cervello è stato ritenuto privo di un sistema linfatico proprio, questione che ha sollevato molti enigmi circa la modalità di smaltimento dei rifiuti prodotti. Altra domanda cruciale che ne conseguiva era relativa a come il sistema immunitario potesse raggiungerlo e agire al suo interno. Una delle peculiarità del sistema nervoso centrale, infatti, è la presenza della barriera emato-encefalica, sistema anatomico-funzionale costituito da cellule endoteliali strettamente adese e dalle protrusioni di particolari cellule nervose dette astrociti. Questa barriera è in grado di svolgere un ruolo molto selettivo nel separare cervello e sangue circolante e nel regolare il passaggio di sostanze dall’uno all’altro e viceversa: gli scambi dipendono da trasportatori attivi specifici.
Se si considera lo smaltimento sono quindi stati individuati due sistemi: uno vascolare, ovvero la barriera emato-encefalica, ed uno paravascolare (Cserr and Ostrach, 1974; Ichimura et al., 1991; Yamada et al., 1991; Abbott, 2004): il fluido cerebro-spinale entra attraverso gli spazi che circondano le arterie e attua gli scambi con il liquido interstiziale, che drena nel sistema venoso. Vista la funzione analoga a quella del sistema linfatico e il coinvolgimento di un canale per l’acqua (aquaporina 4, AQP- 4) a livello degli astrociti, cellule che fanno parte della glia (un insieme di cellule che nutre e protegge i neuroni e la loro attività), in inglese è stato clonato un nuovo termine per indicarlo: glymphatic, fusione di “glia” e “lymphatic” (linfatico). Dopo il sistema “glinfatico” si ritiene che il liquido cerebrospinale pervenga alla circolazione venosa passando per le granulazioni aracnoidee. Ulteriori studi, in ogni caso, hanno mostrato che una parte consistente di questo liquido è drenato, con un meccanismo fino a poco tempo fa non chiaro, nei vasi linfatici al di fuori del cranio e nei linfonodi (Koh e coll, 2005).
Nel 2013 Iliff e colleghi hanno dimostrato come la forza trainante del passaggio di soluti sarebbe la fisiologica pulsazione delle pareti arteriose: garantirebbe l’efflusso dei soluti in direzione opposta alla propagazione dell’onda. Il fatto, oltretutto, che le arterie penetranti mostrino la pulsatitlità più marcata e la maggior sensibilità ad eventuali occlusione delle carotidi interne, va favore del loro ruolo cruciale nello scambio paravascolare tra fluido interstiziale e fluido cerebro-spinale. Una riduzione della loro pulsabilità, evento facilitato dall’avanzamento dell’età, comporterebbe una riduzione della rimozione dei soluti e favorirebbe la deposizione della beta amiloide nel parenchima cerebrale. E’ stato osservato come la rapidità dello scambio vari molto a seconda che sia la superficie cerebrale o lo spazio subaracnoideo: questo lascia intendere un’organizzazione degli spazi in diversi sottocompartimenti, necessari a far muovere rapidamente il liquido cerebrospinale e a consentire lo scambio con il fluido interstiziale. Il liquido interstiziale verrebbe ripulito per la maggior parte attraverso canali paravascolari che circondano le vene di grande calibro (Iliffet al, 2012) riversando i soluti, beta-amiloide compresa, nel fluido cerebro-spinale subaracnoideo, successivamente eliminato dal plesso corioideo.
Studi più recenti hanno individuato un ulteriore possibile meccanismo di rimozione dei soluti- compresa la beta-amiloide – mediante la fuoriuscita tra le cellule muscolari lisce della tonaca media. Questo meccanismo spiegherebbe anche la deposizione di beta-amiloide lungo le arterie penetranti e leptomeningee, problematica coinvolta nell’angiopatia amilodea (Weller et al., 2008; Hawkes et al., 2011).
La proteina beta amiloide
La beta amiloide è una proteina con risvolti importanti per la salute dell’organismo. E’ coinvolta in diverse forme degenerative cerebrali, come l’angiopatia amiloide e il morbo di Alzheimer. Questa proteina disfunzionale, infatti, ha un ruolo importante nella distruzione delle sinapsi (Taeho et al, 2013) e nella regolazione della concentrazione intracellulare di Calcio, inoltre tende all’accumulo e alla progressiva aggregazione che porta alla formazione di placche, la cui deposizione è associata a processi infiammatori e degenerativi con lo sviluppo della complessa sintomatologia delle malattie sopracitate.
Il fatto che la beta amiloide si depositi lungo le pareti delle arterie cerebrali e leptomeningee comporta l’alterazione della membrana basale ed anche l’eventuale distruzione delle cellule muscolari lisce (Weller et al., 2009). Nell’Alzheimer, infatti, vi è una componente legata anche a disfuzioni di tipo vascolare: ipoperfusione cerebrale, compromissione della barriera emato-encefalica, infiltrazione da parte di cellule infiammatorie, maggior incidenza di fenomeni emorragici… (Roher et al., 2003; Beach et al., 2007; Brundel et al, 2012; Yarchoan et al., 2012).
Il sistema linfatico del cervello
Due lavori del 2015, indipendenti e quasi contemporanei, cambiano in modo consistente la conoscenza del cervello raggiunta sinora. Sebbene per il momento siano stati eseguiti esclusivamente su cavie di laboratorio hanno grande valenza scientifica.
Louveau e colleghi, dell’Università di Virginia, hanno infatti scoperto l’esistenza di vasi linfatici funzionali che avvolgono i seni della dura madre (canali venosi contenuti nello spessore di due pliche della dura madre encefalica che drenano il sangue delle strutture nervose intracraniche alla vena giugulare interna): sono vasi che esprimono tutti i marker dei vasi linfatici (affrontati in precedenza) in grado di trasportare sia soluti e fluidi che cellule del sistema immunitario. Sono inoltre connessi a linfonodi cervicali profondi. I vasi linfatici meningei esprimono un pattern di molecole simile ai vasi linfatici del diapramma, e sembrano inoltre privi di valvole linfatiche: i vasi linfatici meningei presentano cacatteristiche tipiche dei vasi linfatici iniziali. Questo sistema linfatico presenta caratteri unici: sembra che parta da entrambi gli occhi e prosegua fin sopra il bulbo olfattorio prima di proseguire nei seni adiacenti. I vasi sono più grandi e complessi a livello del seno trasverso rispetto al seno saggittale superiore. Presentano inoltre una connessione diretta con i linfonodi cervicali profondi, ma non quelli superficiali. Quindi questo sistema rinvenuto potrebbe rappresentare la seconda fase di drenaggio del liquido interstiziale, dopo il passaggio per il sistema glinfatico.
A risultati analoghi sono pervenuti, in modo indipendente, Aspelund e colleghi di Helsinki, che hanno osservato come i vasi linfatici siano relativamente scarsi nelle porzioni superiori del cranio, mentre la base del cranio presenta un network molto più fitto e dotato anche di valvole (poco numerose). tutti i dati riportati fanno intendere come i vasi linfatici siano presenti nella dura madre e drenino fuori dal cervello attraverso il foro occipitale alla base del cranio seguendo il percorso dei vasi arteriosi e venosi e dei nervi cranici. Dagli esperimenti condotti hanno visto come il cervello di fatto possegga diversi sistemi per gestire il liquido fuoriuscito dai vasi sanguigni, efficaci anche nel momento in cui venga asportata la dura madre.
L’importanza del sonno
Il fatto che il sonno (al riguardo: Obiettivo salute: vivere meglio in 4 mosse) si sia conservato in tutte le specie animali è indice che rivesta una funzione singolarmente importante: assicura il mantenimento di una corretta omeostasi metabolica. Lo studio di Xie e colleghi del 2013 ha messo in luce che il sonno naturale può arrivare ad aumentare di ben il 60% lo spazio interstiziale, favorendo il miglioramento dello scambio del liquido cerebro-spinale con il fluido interstiziale. Ne consegue anche un aumento dell’eliminazione di beta-amiloide. E se l’effetto ristorativo del sonno fosse proprio il risultato di questa sua promozione dell’allontamento di sostanze tossiche accumulate da svegli? Al tempo stesso potrebbe giustificare quel progressivo peggioramento di alcune funzioni cerebrali (apprendimento, memorizzazione, tempi di reazione rapidi,…) tipiche dell’assenza di sonno.
La concentrazione di beta amiloide a livello interstiziale, poi, è maggiore in coloro che sono svegli, piuttosto che in quelli che dormono, e probabilmente non perché lo stato di veglia è associato ad una maggior produzione (Bateman et al., 2006; Kang et al., 2009).Lo studio di Xie apre le porte ad una nuova ipotesi: a fare la differenza è la velocità di smaltimento, di gran lunga superiore durante il sonno. Parte del fenomeno è legato ai segnali adrenergici rilasciati durante lo stato di veglia, in grado di modificare il volume e la dimensione delle cellule – mediante la modulazone dell’attività cellulare- e quindi di ridurre lo spazio interstiziale.
Questioni sollevate
L’esistenza di un sistema linfatico a livello cerebrale apre la porta ad innumerevoli rivalutazioni. Il cervello era stato sinora considerato privilegiato dal punto di vista dell’immunità, o meglio segregato: la presenza di linfociti-T è stata sempre considerata di origine autoimmune, in quanto si riteneva che – in assenza di una rete linfatica- i linfociti T e gli anticorpi presenti nel cervello e/o nel liquor fossero considerati autoctoni. Queste scoperte, per ora limitate al mondo animale, necessitano di un’urgente verifica anche nell’uomo, perché comportano una grande evoluzione nella neuroimmunologia: la connessione con la mucosa nasale e con i linfonodi profondi dimostra infatti che non vi è separazione con il resto dell’organismo, e che alcune patologie con una componente neuroinfiammatoria importante (come sclerosi multipla, alzheimer, etc) vanno rivalutate. Proprio il mal funzionamento dei vasi linfatici meningei potrebbe essere causa di queste problematiche, ed anche di disordini neurologici associati a forme di linfedema primitivo. Anche lo studio dei farmaci sarà aperto a nuove prospettive.
L’aspetto più curioso, forse, è che già nel diciottesimo secolo un anatomista italiano, Paolo Mascagni, aveva descritto quello che chiamava vasi linfatici nelle meningi e sulle superfici craniche, senza che però i suoi dati riuscissero mai a veni riprodotti. Almeno sinora.
Conclusioni
Le cellule nervose sono altamente sensibili all’ambiente che le circonda. La scoperta di un sistema linfatico a livello cerebrale apre le porte a nuove prospettive terapeutiche e a nuove connessioni tra cervello e resto del corpo. La consapevolezza che il sonno riveste una parte importante nell’allontamento di sostanze tossiche e dannose dal sistema nervoso centrale può far prendere consapevolezza sull’importanza di dedicare a quest’attività un numero adeguato di ore. Questo è ciò che può essere compiuto attivamente per preservare al meglio le proprie condizioni cerebrali e cercare di ridurre la concentrazione di beta amiloide, fattore di rischio per diverse patologie.
Medicina: crolla il dogma del privilegio immunitario del cervello. Filomena Fotia, 30 giugno 2015
Taeho Kim, George S. Vidal, Maja Djurisic, Christopher M. William, Michael E. Birnbaum, K. Christopher Garcia, Bradley T. Hyman, Carla J. Shatz Human LilrB2 Is a β-Amyloid Receptor and Its Murine Homolog PirB Regulates Synaptic Plasticity in an Alzheimer’s Model Science 20 Sep 2013: Vol. 341, Issue 6152, pp. 1399-1404
Xie L, Kang H, Xu Q, Chen MJ, Liao Y, Thiyagarajan M, O’Donnell J, Christensen DJ, Nicholson C, Iliff JJ, Takano T, Deane R, Nedergaard M. Sleep drives metabolite clearance from the adult brain. Science. 2013 Oct 18;342(6156):373-7. doi: 10.1126/science.1241224
Jeffrey J. Iliff Minghuan Wang, Douglas M. Zeppenfeld, Arun Venkataraman, Benjamin A. Plog, Yonghong Liao, Rashid Deane, and Maiken Nedergaard Cerebral Arterial Pulsation Drives Paravascular CSF–Interstitial Fluid Exchange in the Murine Brain The Journal of Neuroscience, 13 November 2013, 33(46): 18190-18199
Aleksanteri Aspelund, Salli Antila, Steven T. Proul, Tine Veronica Karlsen, Sinem Karaman, Michael Detmar, Helge Wiig, and Kari AlitaloA dural lymphatic vascular system that drains brain interstitial fluid and macromolecules2015 // JEM vol. 212 no. 7 991-999